Viimeisen kymmenen vuoden aikana kryoelektronimikroskopia on noussut pienestä rakennebiologian sivuhaarasta keskeiseksi osaksi biokemiallisia tutkimusmenetelmiä. Kryoelektronimikroskopian kehitys on tuonut rakenteellisen tarkastelun osaksi kaikkea solu- ja molekyylibiologiaa, minkä ansiosta kolme menetelmän kehittäjää palkittiin Nobelin kemian palkinnolla vuonna 2017.
Kryoelektronimikroskopian avulla voidaan ymmärtää tärkeiden biologisten kohteiden kuten virusten tai proteiinien rakennetta ja toimintaa, mikä johtaa merkittäviin läpimurtoihin sekä perustutkimuksen että soveltavan biologian osalta. Menetelmä helpottaa esimerkiksi hermosolujen toiminnan kannalta keskeisten ionikanavien tutkimusta ja mahdollistaa parempien rokotteiden suunnittelun.
Perinteisten menetelmien ongelmat
Molekyylibiologian tarkoituksena on ymmärtää tarkkaan, kuinka biologisesti merkittävät makromolekyylit, kuten entsyymit tai DNA reagoivat toistensa kanssa. Ongelmana on kuitenkin se, että tutkittavat kohteet ovat liian pieniä nähtäviksi. Tämän takia molekyylibiologiaa on perinteisesti ollut aina enemmän tai vähemmän epäsuoraa. Varsinkin molekyylien rakenteiden tutkiminen on huomattavasti helpompaa, jos niistä voidaan rakentaa kolmiulotteisia rekonstruktioita. Tämä onkin rakennebiologian keskeinen tavoite. Makromolekyylien rakenteiden ymmärtäminen on välttämätöntä niiden toiminnan ymmärtämiseksi. Esimerkiksi proteiinien ja RNA:n monimutkaiset 3D-rakenteet ovat välttämättömiä niiden toiminnan kannalta.
Makromolekyylien rakenteet määrittyvät niiden atomien välisten vuorovaikutusten kautta. Koska atomien väliset sidokset ovat hyvin lyhyitä, vain ångströmien luokkaa (Å, 0,1 nm), on rakennebiologisten rekonstruktioiden oltava hyvin tarkkoja. Parhaiden 3D-mallien resoluutio, eli erottelutarkkuus on vain muutamia ångströmejä. Mitä korkearesoluutioisempi rekonstruktio on, sitä helpompi sitä on käyttää biologisten ongelmien ratkaisemissa, koska korkea resoluutio mahdollistaa jopa yksittäisten atomien mallintamisen. Tällaisen rekonstruktion avulla esimerkiksi entsyymien aktiivisten kohtien tai proteiinien välisten kiinnityskohtien tutkiminen on helppoa.
Rakennebiologisia 3D-malleja voidaan tuottaa useilla tekniikoilla. Näistä ylivoimaisesti käytetyin on röntgenkristallografia, joka perustuu kristallisoitujen makromolekyylien kykyyn taittaa röntgensäteitä. Röntgenkristallografialla päästään korkearesoluutioisiin rekonstruktioihin, ja sen avulla on ratkaistu monien tärkeiden proteiinien sekä DNA:n rakenne. Röntgenkristallografia soveltuu kuitenkin vain murto-osalle biologisesti merkittävistä molekyyleistä. Sitä varten tarvitaan suuria näytemääriä, joiden valmistaminen voi olla haastavaa. Itse kristallit ovat menetelmän suurin ongelma, koska niiden tuotanto vaatii hyvin tarkkoja, näytekohtaisia olosuhteita, joiden löytämisessä voi kestää vuosia. Kristalleissa makromolekyylit ovat myös vahvasti järjestäytyneessä muodossa, mikä vaikuttaa niiden rakenteeseen. Röntgenkristallografialla saadut tulokset eivät siis välttämättä vastaa biologisia olosuhteita lainkaan.
Toinen perinteinen rakennebiologinen metodi on ydinmagneettiseen resonanssiin perustuva NMR-spektroskopia (nuclear magnetic resonance spectroscopy). Sitä käytettäessä tutkittavaa näytettä ei tarvitse kristallisoida, mutta sitä tarvitaan silti suuria määriä. Näytemolekyyleihin on myös rikastettava tavallisten atomien tilalle niiden raskaampia isotooppeja, yleensä typpi-15:sta. NMR-spektroskopiassa näytteitä käsitellään lähes luonnollisissa olosuhteissa, mutta tekniikan suurin rajoite on kuitenkin se, että se soveltuu vain suhteellisen pienille makromolekyyleille (Nogales, 2015).
Kryoelektronimikroskopia on röntgenkristallografiaa ja NMR-spektroskopiaa yksinkertaisempi menetelmä, koska siinä näytettä tarvitaan suhteellisen vähän, eikä sitä tarvitse kristallisoida tai rikastaa raskailla atomeilla. Se soveltuu myös hyvin erikokoisille makromolekyyleille aina pienistä entsyymeistä suuriin viruksiin. Perinteisesti kryoelektronimikroskopian resoluutio on ollut NMR-spektroskopiaa ja röntgenkristallografiaa heikompi, mutta viimeaikaisen teknisen kehityksen myötä sillä päästään rutiininomaisesti korkeaan resoluutioon. Kryoelektronimikroskopian monikäyttöisyys yhdistettynä korkeaan resoluutioon tekee siitä nykyisin monikäyttöisimmän rakennebiologisen tekniikan (Nogales, 2015).
Elektronimikroskopiaa hyytävän kylmässä
Elektronimikroskopia perustuu samankaltaisille periaatteille kuin perinteinen valomikroskopia, jota käytetään pienten kohteiden, kuten solujen tarkkailuun. Niin kutsutun superresoluutiomikroskopian avulla valomikroskopialla voidaan havainnoida jopa yksittäisiä proteiineja, mutta makromolekyylien sisäiseen rakenteeseen sillä ei päästä käsiksi. Valomikroskooppien resoluutiota rajaa valon aallonpituus, minkä takia se jää parhaimmillaan satoihin mikrometreihin. Esimerkiksi useimmat virukset ovat halkaisijaltaan kymmeniä nanometrejä, yksittäisistä makromolekyyleistä puhumattakaan, joten näiden tarkkaan havainnointiin käytetään elektronimikroskopiaa. Koska elektronien aallonpituus on noin tuhat kertaa valoa lyhyempi, elektronimikroskoopin resoluutio on huomattavasti korkeampi kuin valomikroskopiassa.
Elektronimikroskopia jakautuu kahteen päätyyppiin, läpäisy- ja pyyhkäisyelektronimikroskopiaan. Läpäisyelektronimikroskopiassa (transmission electron microscopy, TEM) havainnoidaan tutkittavan kohteen läpäisseitä elektroneja ja näin saadaan tietoa sen sisäisestä rakenteesta. TEM-tekniikka soveltuu esimerkiksi yksittäisten virusten tai soluelinten tutkimiseen. SEM-lähestymistapaa (scanning electron microscopy) eli pyyhkäisyelektronimikroskopiaa käytetään tutkittaessa esimerkiksi mikroskooppisten eläinten tai solujen pintarakenteita havainnoimalla näytteen pinnalta sironneita elektroneja.
Kryoelektronimikroskopia on TEM-tekniikan erikoissovellus, joka eroaa perinteisestä läpäisyelektronimikroskopiasta näytteenvalmistustekniikan osalta. Vaikka esimerkiksi metallikomponenttien TEM-tutkimuksilla päästään helposti korkeaan resoluutioon, ei biologisten näytteiden kuvaaminen ole läheskään yhtä suoraviivaista. Elektronimikroskooppien tyhjiö vahingoittaa biologisia näytteitä, voimakastehoisesta elektronisuihkusta puhumattakaan. Biologinen materiaali koostuu myös suurimmaksi osaksi kevyistä alkuaineista, mikä johtaa matalaan kontrastiin. Tämä puolestaan vaikeuttaa yksityiskohtien havaitsemista. Ongelman ratkaisemiseksi on kehitetty raskasmetallien suoloja hyödyntävä tekniikka, negatiivivärjäys, jota voidaan käyttää suurten kohteiden, kuten solujen tai virusten tutkimisessa. Negatiivivärjäyksellä ei kuitenkaan päästä korkeaan resoluutioon, joten se ei sovi varsinaiseen rakennebiologiseen tutkimukseen (Nogales, 2015).
Kryoelektronimikroskopiassa ei käytetä negatiivivärjäystä, vaan näytteet valmistetaan ilman raskasmetallisuoloja. Näytteiden valmistus perustuu 1970-luvulla tehtyihin havaintoihin siitä, että hyvin kylmässä nopeasti jäätyvä vesi ei muodosta kristalleja vaan lasimaista jäätä. Elektronit läpäisevät tällaisen jään tehokkaasti (Taylor & Glaeser, 1974). Lasimaisen jään havaittiin suojaavan biologisia näytteitä tyhjiöltä, jolloin pieniä elektronimääriä käyttäen niistä pystyttiin keräämään korkearesoluutioista dataa näytteitä tuhoamatta (Dubochet ym., 1982; Adrian ym., 1984). Kryoelektronimikroskopiaa varten tutkittavia kohteita ei siis negatiivivärjätä, vaan ne jäädytetään hyvin ohuen lasijääkerroksen sisään. Tämä tapahtuu käyttäen nestemäisellä typellä jäähdytettyä etaania tai propaania (lämpötila noin -160 °C). Jotta näyte ei vahingoittuisi, säilytetään se nestemäisessä typessä ja se pidetään kylmänä myös itse kuvaustilanteessa.
Tavoitteena tarkka 3D-malli
Näytteidenvalmistusteknologian lisäksi kryoelektronimikroskopia eroaa tavallisesta TEM-mikroskopiasta myös tavoitteeltaan. Kryoelektronimikroskopia, kuten muutkin rakennebiologiset tekniikat, pyrkii tuottamaan tutkittavasta kohteesta tarkan kolmiulotteisen rekonstruktion. TEM puolestaan keskittyy suurempiin linjoihin, ja tuottaa 2D-tuloksia. Vaikka elektronimikroskooppikuvat ovat kaksiulotteisia, voidaan useita kuvia yhdistämällä rakentaa 3D-malli näytteestä. Tätä varten tutkittava makromolekyyli on kuvattava useista suunnista, jotta kaikki sen rakenteellinen informaatio saadaan näkyviin. Tähän on kaksi tapaa. Kryoelektronitomografiassa (cryo-electron tomography, cryo-ET) keskitytään yksittäiseen partikkeliin, jota käännetään ja kuvataan useista suunnista. Tällöin on käytettävä hyvin pieniä elektronimääriä, näytteen vahingoittumisen välttämiseksi, jolloin myös kontrasti on hyvin heikko. Tämän takia cryo-ET:n avulla ei voida tuottaa korkearesoluutioisia rekonstruktioita, mutta se on silti hyödyllinen monissa tapauksissa. Esimerkiksi HI-viruksen kaltaisten epäsymmetristen kohteiden mallintamisessa cryo-ET on erittäin hyödyllinen (Liu ym., 2011; Wan & Briggs, 2016).
”Varsinaisen” kryoelektronimikroskopian (single-particle cryo-electron microscopy, cryo-EM) avulla päästään kryoelektronitomografiaa korkeampiin resoluutiohin, ja juuri se toimii kryoelektronimikroskopian lippulaivatekniikkana. Englanninkielisestä nimestään huolimatta cryo-EM-lähestymistavassa kuvataan tuhansia partikkeleja, joista kootaan malli yksittäisestä kappaleesta. Ajatuksena on se, että näytehilassa jäätyessään partikkelit ovat satunnaisissa asennoissa, jolloin tarpeeksi suuri määrä partikkeleja kuvaamalla saadaan rakenteellista informaatiota kaikilta puolilta partikkelia. Koska jokainen partikkeli kuvataan vain kerran, ei näytteen vahingoittumista tarvitse varoa yhtä paljon kuin cryo-ET-tekniikan kanssa. Käyttämällä suurempaa elektroniannosta kontrasti kasvaa, ja korkeaan resoluutioon on helpompi päästä. Kokoamalla tuhansien partikkelien sisältämä informaatio yhteen, voidaan muodostaa kolmiulotteinen rekonstruktio yksittäisestä partikkelista. Tällöin myös yksittäisissä kuvissa näkymättömissä olevat yksityiskohdat tulevat esiin (Cheng, 2015).
Havainnointitekniikan kehitys johti atomitason resoluutioon
Korkearesoluutioisten rekonstruktioiden rakentaminen oli mahdotonta cryo-EM-tekniikan kehityksen alkuvaiheissa teknisistä syistä. Koska yksittäisiin cryo-EM kuviin voidaan materiaalin herkkyyden takia käyttää vain pieniä elektroniannoksia, jää signaali heikoksi. Sen vahvistaminen on periaatteessa hyvin yksinkertaista kasvattamalla otettujen kuvien määrää. Tämä ei kuitenkaan ollut mahdollista aikaisemmin, koska kuvat otettiin hitaasti elektroniherkkää filmiä käyttäen. Cryo-EM soveltuikin vain harvoille kohteille. Näistä merkittävimpiä olivat virukset ja ribosomit. Koska virukset ovat hyvin symmetrisiä, voidaan niitä kuvatessa signaalia vahvistaa laskennallisesti symmetriaa hyödyntäen. Ribosomit koostuvat proteiinin lisäksi fosforia sisältävästä RNA:sta. Fosforiatomit ovat suhteellisen suuria, jonka takia ne siroavat elektroneja muita biologisen materiaalin atomeja paremmin, mikä parantaa kuvien kontrastia. Tämä johtaa vahvempaan signaaliin ja tätä kautta korkeampaan resoluutioon. Cryo-EM-tekniikalla selvitetyt virusten ja ribosomien rakenteet kertoivat jo aikaisessa vaiheessa menetelmän potentiaalista: sekä virukset että ribosomit ovat suuria makromolekyylikomplekseja, joiden tutkiminen perinteisillä rakennebiologisialla tekniikoilla on haastavaa (Frank, 2016).
Cryo-EM-tekniikan kehityksessä merkittävä askel oli CCD-kameroiden (charged couple device) käyttöönotto. CCD-kamerat mahdollistivat cryo-EM-kuvien helpon digitaalisen varastoimisen, mikä mahdollisti datankeruuprosessin automatisoimisen. Tämä johti huomattavasti aikaisempaa suurempiin kuvamääriin ja tätä kautta korkeampaan resoluutioon. CCD-kameroiden haittana oli se, että elektronit havainnointiin epäsuorasti valon avulla. Tämä johti yksittäisissä kuvissa filmiä suurempaan kohinaan (Frank, 2016).
Alan mullistavin muutos oli suorien elektronihavaitsimien (direct electron detector, DED) käyttöönotto 2000-luvun lopulla. Koska DED-laitteet havaitsevat elektronit suoraan, ei niitä käyttäessä synny samanlaista kohinaa kuin CCD-kameroita käytettäessä. Digitaalinen datankeruu on kuitenkin DED-laitteilla jopa CCD-kameroita helpompaa. Niiden avulla voidaan siis kuvata suuria määriä korkearesoluutioisia kuvia, jolloin resoluutio kasvaa. DED-havaitsimien avulla mallien resoluutiota pystyttiin kasvattamaan myös epäsuorilla tavoilla. Niiden herkkyyden ansiosta voidaan cryo-EM-kuvat ottaa käyttäen useita pieniä elektronipulsseja yhden suuren sijaan. Tämä mahdollistaa kaikkein pienimpien ja herkimpien yksityiskohtien havaitsemisen ennen kuin elektronisuihku tuhoaa ne. Tällä lähestymistavalla voidaan myös laskennallisesti kompensoida elektronisuihkun aiheuttamaa näytteen liikkumista, mikä parantaa tarkkuutta entisestään (Frank, 2016). DED-havaitsimien myötä cryo-EM-rekonstruktioissa saavutettiin niin sanottu atomitason resoluutio ensimmäistä kertaa ja nykyisin tähän resoluutioon päästää suhteellisen helposti (Yu ym, 2008; Zhang ym., 2008).
Myös rekonstruktioden tuottamisessa käytettävien laskennallisten menetelmien kehitys on ollut tärkeässä osassa cryo-EM-historiaa. Niiden avulla suuria osia cryo-EM-rekonstruktioiden tuottamisesta on automatisoitu, mikä mahdollistaa suurten kuvamäärien käytön ja tätä kautta korkean resoluution. Näiden valtavien kuvamäärien käsittelyyn käytetään supertietokoneita, joiden yleistyminen on mahdollistanut cryo-EM-tekniikan kehityksen. Tärkeässä roolissa cryo-EM-tekniikan leviämisessä spesialistipiirien ulkopuolelle on ollut myös rekonstruktio-ohjelmien kehitys helppokäyttöisemmiksi (Frank, 2016).
Cryo-EM tekee rakennebiologiasta arkipäivää
Cryo-EM on perinteisiä rakennebiologisia tekniikoita yksinkertaisempi ja soveltuu useammille makromolekyylityypeille. Hyvänä esimerkkinä toimivat kaksi ensimmäistä korkearesoluutioista rekonstruktiota ihmisiä infektoivista adenoviruksista. Sekä röntgenkristallografiarekonstruktio että cryo-EM-rekonstruktio julkaistiin Science-lehden samassa numerossa. Siinä vaiheessa röntgenkristallografiarekonstruktion tuottamisessa oli kestänyt kaksitoista vuotta, mutta cryo-EM-rekonstruktio oli valmistunut kuukausissa (Liu ym., 2010; Ono, 2010; Reddy ym., 2010). Cryo-EM-tekniikan yksinkertaisuus ja nopeus mahdollistavat sen helpon käyttöönoton myös niissä laboratorioissa, joissa cryo-EM-tutkimusta ei aikaisemmin ole tehty. Nyt monia biologisia ilmiöitä voidaan tarkastella niihin osallistuvien molekyylien rakenteiden kautta, mikä tuo tutkimukseen uuden ulottuvuuden. Perustutkimuksen lisäksi myös yksityinen sektori on ottanut cryo-EM:n käyttöön laaja-alaisesti ja sitä hyödynnetään esimerkiksi lääketeollisuudessa. Sen avulla voidaan selvittää atomitasolla muun muassa synteettisesti tuotettujen nanopartikkelien rakenne tai lääkeainemolekyylin tarkka sitoutuminen kohdeproteiiniinsa (Yu ym., 2015; Merk ym., 2016).
Kryoelektronimikroskopian teoreettinen potentiaali tiedettiin jo sen kehityksen aikaisessa vaiheessa (Henderson, 1995). Vasta viimeaikainen tekninen kehitys on mahdollistanut sen hyödyntämisen. Erityisen merkittävää on se, että cryo-EM eroaa muista rakennebiologisista tekniikoista yksinkertaisuutensa ja laaja-alaisuutensa vuoksi. Tämän takia sitä voidaan käyttää myös spesialistilaboratorioiden ulkopuolella ja cryo-EM onkin viimein valmis ottamaan paikkansa yhtenä molekyylibiologian – ei vain rakennebiologian – keskeisistä menetelmistä.
Teksti: Lauri Pulkkinen, väitöskirjatutkija, Helsingin yliopisto
Artikkeli on julkaistu Naturan numerossa 1/2018.
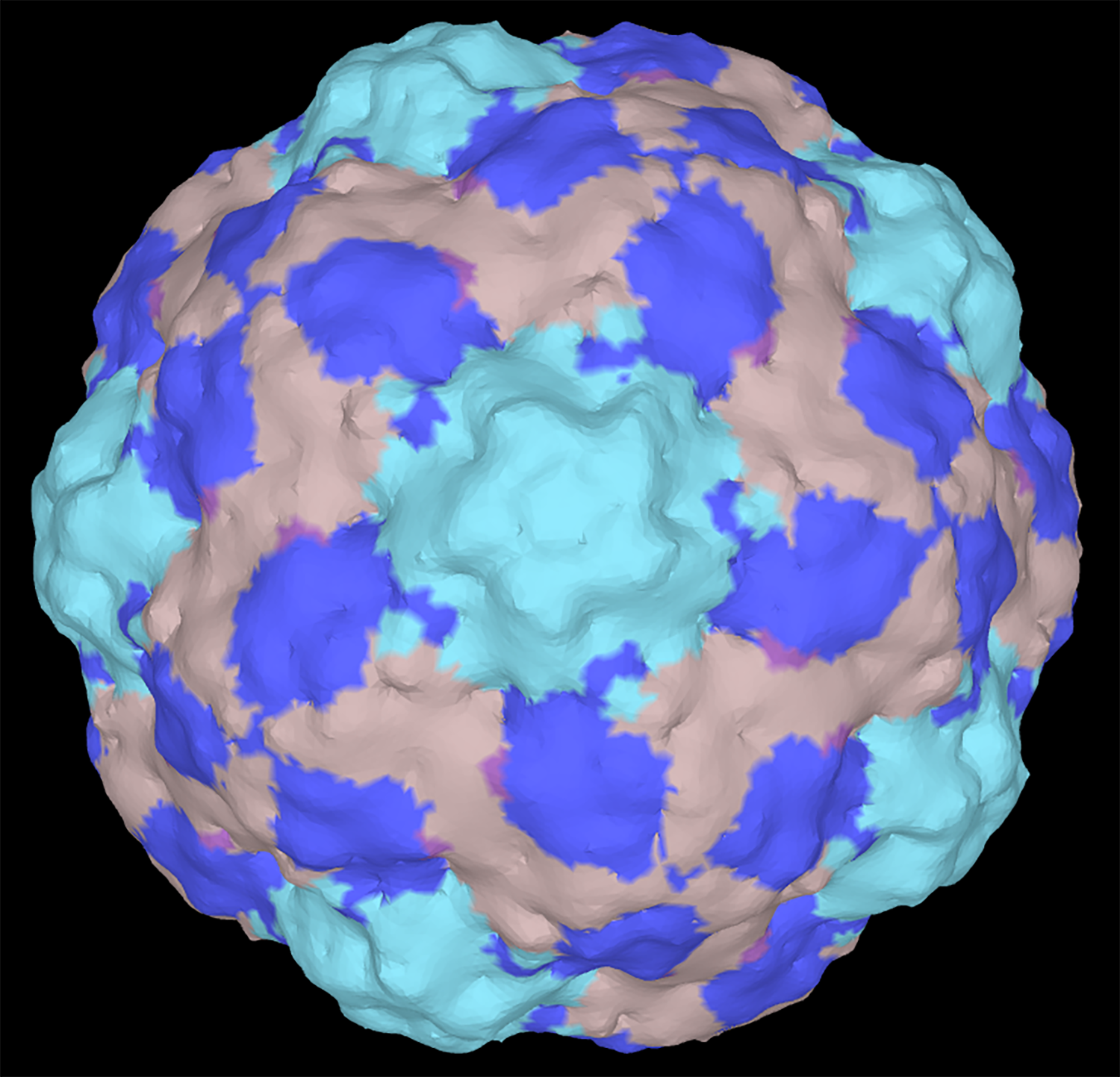
Kuva ylhäällä: Cryo-EM-rekonstruktio vastasyntyneissä aivokuumetta aiheuttavasta human parechovirus 3 (HPeV 3) -viruksesta. Viruspartikkelin eri proteiinit on värjätty jälkikäteen tietokoneella. Rekonstruktion resoluutio on 4,3 Å (Shakeel ym., 2016).
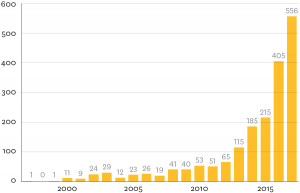
RSCB Protein Data Bank -tietokantaan vuosittain lisättyjen cryo-EM-rekonstruktioiden määrä on kasvanut huimasti suorien elektronidetektorien käyttöönoton jälkeen 2010-luvulla (Berman ym., 2000).

Tutkimusteknikko Benita Löflund (vas.) ja tutkijatohtori Anja Paatero valmistavat kasviribosominäytteitä cryo-EM-analyysiä varten. Kuva: Lauri Pulkkinen.
Lähteet
Adrian M., Dubochet J., Lepault J. & McDowall A. W. (1984) Cryo-electron microscopy of viruses. Nature, 308, 32–36
Berman H.M., Westbrook J., Feng Z., Gilliland G., Bhat T. N., Weissig H., Shindyalov I. N. & Bourne P. E. (2000) The protein data bank. Nucleic Acids Research, 28, 235–242
Cheng Y. (2015) Single-particle Cryo-EM at crystallographic resolution. Cell, 161, 450–457
Dubochet J., Chang J-J., Freeman R., Lepault J. & McDowall A. W. (1982) Frozen Aqueous Suspensions. Ultramicroscopy, 10, 55–61
Frank J. (2016) Generalized single-particle cryo-EM – a historical perspective. Microscopy, 65, 3–8
Henderson R. (1995) The Potential and Limitations of Neutrons, Electrons and X-Rays for Atomic Resolution Microscopy of Unstained Biological Molecules. Quarterly Review of Biophysics, 28, 171–193
Liu H., Jin L., Koh S. B. S., Atanasov I., Schein S., Wu L. & Zhou Z. H. (2010) Atomic structure of human adenovirus by Cryo-EM reveals interactions among protein networks. Science, 329, 1038–1043
Liu J., Wright E. E., Winkler H. (2011) 3D Visualization of HIV Virions by Cryoelectron Tomography. Methods in Enzymology, 483, 267–290
Merk A., Bartesaghi A., Banerjee S., Falconieri V., Rao P., Davis M. I., Pragani R., Boxer M. B., Earl L. A., Milne J. L. S. & Subramaniam S. (2016) Breaking Cryo-EM Resolution Barriers to Facilitate Drug Discovery. Cell, 165, 1698–1707
Nogales E. (2015) The development of cryo-EM into a mainstream structural biology technique. Nature Methods, 13, 24–27
Ono M. (2010) Scientists Unveil Structure of Adenovirus, the Largest High-Resolution Complex Ever Found. https://www.scripps.edu/newsandviews/e_20100830/adenovirus.html Luettu 31.1.2018
Reddy V., Natchiar S., Stewart P. & Nemerow G. (2010) Crystal structure of human adenovirus at 3.5 Å resolution. Science, 329, 1071–1075
Shakeel S., Westerhuis B. M., Domanska A., Koning R. I., Matadeen R., Koster A. J., Bakker A. Q., Beaumont T., Wolthers K. C. & Butcher S. J. (2016) Multiple capsid-stabilizing interactions revealed in a high-resolution structure of an emerging picornavirus causing neonatal sepsis. Nature Communications, 7, 11387
Taylor K. A. & Glaeser R. M. (1974) Electron Diffraction of Frozen, Hydrated Protein. Science, 186, 1036–1037
Wan W. & Briggs J. A. G. (2016) Cryo-Electron Tomography and Subtomogram Averaging. Methods in Enzymology, 579, 329–367
Yu G., Yan R., Zhang C., Mao C. & Jiang W. (2015) Single-Particle Cryo-EM and 3D Reconstruction of Hybrid Nanoparticles with Electron-Dense Components. Small, 11, 5157–5163
Yu X., Jin L. & Zhou Z. H. (2008) Structure of cytoplasmic polyhedrosis virus by cryo-electron microscopy. Science, 453, 415–420
Zhang X., Settembre E., Xu C., Dormitzer P. R., Bellamy R., Harrison S. C. & Grigorieff N. (2008) Near-atomic resolution using electron cryomicroscopy and single-particle reconstruction. Proceedings of the National Academy of Sciences, 105, 1867–1872